《遼寧省凌海市高中化學(xué) 第1章 認(rèn)識化學(xué)科學(xué) 第3節(jié) 化學(xué)中常用的物理量——物質(zhì)的量(第3課時)學(xué)案魯科版必修1》由會員分享����,可在線閱讀,更多相關(guān)《遼寧省凌海市高中化學(xué) 第1章 認(rèn)識化學(xué)科學(xué) 第3節(jié) 化學(xué)中常用的物理量——物質(zhì)的量(第3課時)學(xué)案魯科版必修1(5頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、遼寧省凌海市高中化學(xué) 第1章 認(rèn)識化學(xué)科學(xué) 第3節(jié) 化學(xué)中常用的物理量——物質(zhì)的量(第3課時)學(xué)案魯科版必修1
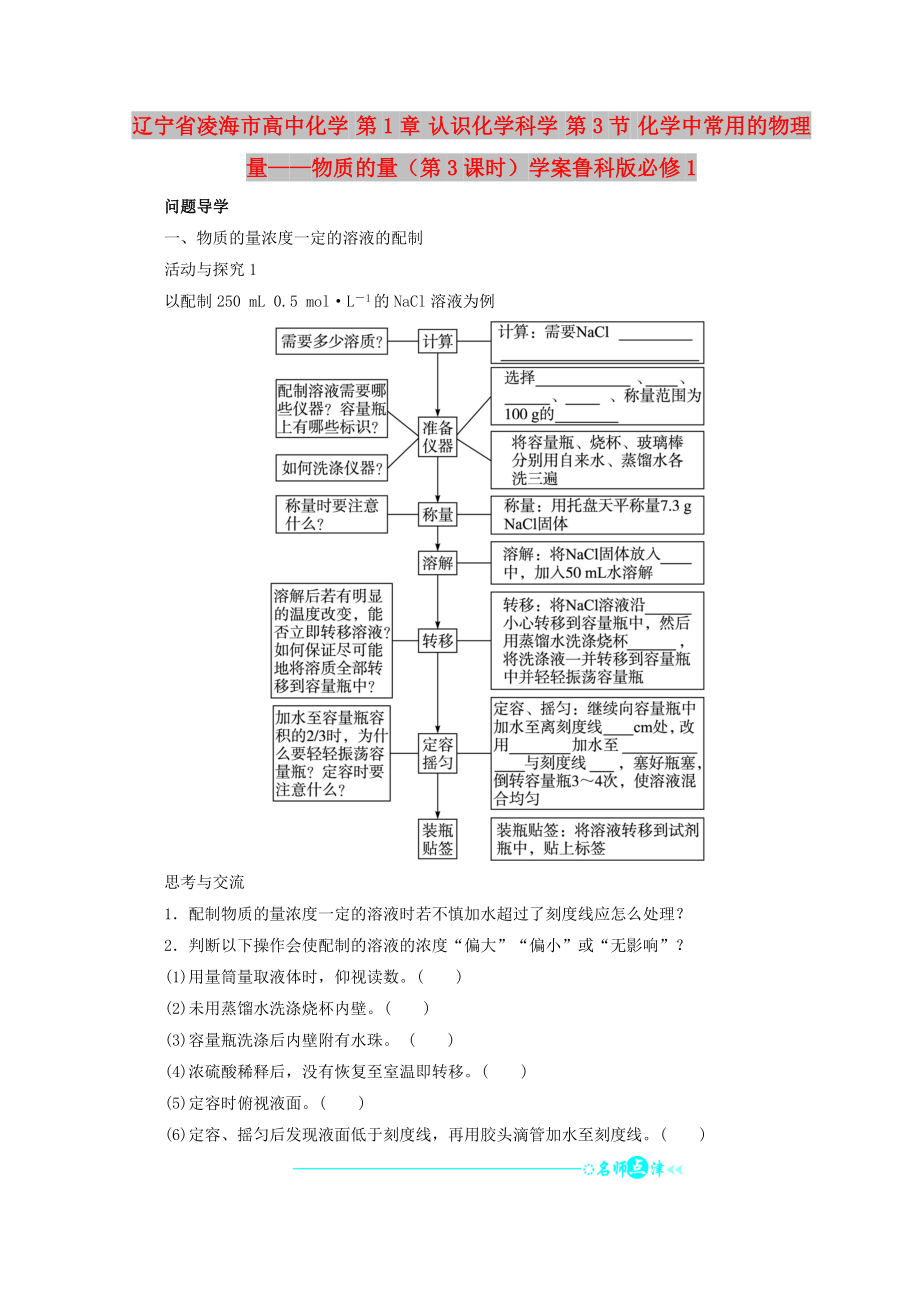
問題導(dǎo)學(xué)
一����、物質(zhì)的量濃度一定的溶液的配制
活動與探究1
以配制250 mL 0.5 mol·L-1的NaCl溶液為例
思考與交流
1.配制物質(zhì)的量濃度一定的溶液時若不慎加水超過了刻度線應(yīng)怎么處理?
2.判斷以下操作會使配制的溶液的濃度“偏大”“偏小”或“無影響”���?
(1)用量筒量取液體時�,仰視讀數(shù)�����。( )
(2)未用蒸餾水洗滌燒杯內(nèi)壁�。( )
(3)容量瓶洗滌后內(nèi)壁附有水珠。 ( )
(4)濃硫酸稀釋后,沒有恢復(fù)至室溫即轉(zhuǎn)移���。( )
(5)定容時
2����、俯視液面���。( )
(6)定容����、搖勻后發(fā)現(xiàn)液面低于刻度線�����,再用膠頭滴管加水至刻度線�。( )
1.分析誤差時,要根據(jù)c=n/V���,圍繞操作行為對n與V的影響來分析��。
以配制一定物質(zhì)的量濃度的NaOH溶液為例
可能引起誤差的一些操作
過程分析
對c的影響
稱量過程
稱量時間過長
減小
—
偏低
用濾紙稱NaOH固體
減小
—
偏低
物質(zhì)��、砝碼位置放反(使用了游碼)
減小
—
偏低
配制過程
移液前容量瓶內(nèi)有少量水
不變
不變
無影響
轉(zhuǎn)移液體時有少量灑落
減小
—
偏低
未洗滌燒杯和玻璃棒
減小
—
偏低
未冷卻到室溫就注入
3�、定容
—
減小
偏高
定容時水加多后用滴管吸出
減小
—
偏低
定容搖勻后液面下降再加水
—
增大
偏低
定容時俯視刻度線
—
減小
偏高
定容時仰視刻度線
—
增大
偏低
2.容量瓶使用六忌:
(1)一忌用容量瓶進(jìn)行溶解(體積不準(zhǔn)確);
(2)二忌直接往容量瓶倒液(灑到外面)���;
(3)三忌加水超過刻度線(濃度偏低);
(4)四忌讀數(shù)仰視或俯視(仰視濃度偏低��,俯視濃度偏高)�����;
(5)五忌不洗滌玻璃棒和燒杯(濃度偏低)�����;
(6)六忌標(biāo)準(zhǔn)液存放于容量瓶(容量瓶是量器����,不是容器)。
二��、有關(guān)物質(zhì)的量濃度的計算
活動與探究2
實驗室用質(zhì)量分?jǐn)?shù)為
4�����、98%�����、密度為1.84 g·cm-3的濃硫酸來配制500 mL 1 mol·L-1的稀硫酸,則
(1)濃硫酸的物質(zhì)的量濃度為多少�?
(2)所需濃硫酸的體積是多少?
思考與交流
若將0.1 mol Na2O溶于水得到1 L溶液��,則所得溶液的物質(zhì)的量濃度是否為0.1 mol·L-1?
1.溶液稀釋前后����,溶質(zhì)的物質(zhì)的量和溶質(zhì)的質(zhì)量都不發(fā)生變化。即c1V1=c2V2���;m1w1=m2w2�����。
2.一般根據(jù)V=計算溶液的體積���。
3.根據(jù)M=來確定物質(zhì)的相對分子質(zhì)量或相對原子質(zhì)量是高中階段經(jīng)常使用的方法。
當(dāng)堂檢測
1.如圖表示配制一定物質(zhì)的量濃度的NaCl溶液的部分操作示意圖���,其中有錯
5����、誤的是( )
2.下列有關(guān)0.1 mol·L-1 NaOH溶液的敘述正確的是( )
A.1 L該溶液中含有NaOH 40 g
B.100 mL該溶液中含有OH- 0.01 mol
C.從1 L該溶液中取出100 mL,所取出的NaOH溶液的濃度為0.01 mol·L-1
D.在1 L水中溶解4 g NaOH即可配制得0.1 mol·L-1 NaOH溶液
3.今有0.1 mol·L-1 NaCl溶液300 mL,0.1 mol·L-1 MgCl2溶液200 mL����,0.1 mol·L-1 AlCl3溶液100 mL,這三種溶液中Cl-物質(zhì)的量濃度之比是( )
A.3∶4∶3
6����、 B.3∶2∶3
C.1∶1∶1 D.1∶2∶3
4.實驗室需要配制230 mL 1 mol·L-1的NaOH溶液����,其實驗步驟為(請將步驟中空白處填寫完整):
①計算所需氫氧化鈉固體的質(zhì)量為________g;
②稱量氫氧化鈉固體�;
③將燒杯中的溶液注入容量瓶,并用少量蒸餾水洗滌燒杯內(nèi)壁2~3次����,洗滌液也注入容量瓶中,輕輕的振蕩��;
④用適量的蒸餾水溶解稱量好的氫氧化鈉固體�����,冷卻至室溫�;
⑤蓋好瓶塞�,搖勻�����;
⑥繼續(xù)向容量瓶中加蒸餾水至刻度線下________時�����,改用________滴加蒸餾水至凹液面最低點與刻度線相切�。
根據(jù)上述信息回答問題:
7、
(1)本實驗操作步驟的正確順序為________�����。
(2)實驗中需要用到容量瓶的規(guī)格為________����。
A.300 mL B.200 mL
C.250 mL D.230 mL
(3)如果實驗遇到下列情況,對該氫氧化鈉的物質(zhì)的量濃度有何影響(填“偏高”“偏低”或者“不變”)��。
①溶解氫氧化鈉固體的燒杯沒有洗滌________����;
②攪拌以加速溶解時不小心灑出一小滴溶液________;
③定容時俯視觀察液面________�����。
(4)實驗過程中如果出現(xiàn)如下情況該如何處理?
①定容后搖勻發(fā)現(xiàn)凹液面最低點低于刻度線________����;
②向容量瓶中
8、轉(zhuǎn)移溶液時不慎將少量溶液灑在容量瓶外________�。
答案:
課堂·合作探究
【問題導(dǎo)學(xué)】
活動與探究1:0.5 mol·L-1×0.25 L×58.5 g·mol-1=7.3 g 250 mL容量瓶 燒杯 玻璃棒 滴管 托盤天平 燒杯 玻璃棒 2~3次 1~2 膠頭滴管 凹液面的最低點 相平
思考與交流:1.答案:應(yīng)倒掉溶液,洗凈容量瓶后重新進(jìn)行配制�。
2.解析:根據(jù)c=n/V進(jìn)行分析����,(1)中仰視讀數(shù),讀數(shù)偏小��,實際體積偏大����,即n偏大,故c偏大���;(2)中未洗滌燒杯內(nèi)壁���,造成n偏小����,故c偏?。?3)對實驗結(jié)果無影響����;(4)中未冷卻至室溫即轉(zhuǎn)移,則造成溶液的體積偏小(熱脹冷縮)�,
9、故c偏大���;(5)定容時俯視液面�����,溶液的實際體積偏小��,故c偏大����;(6)定容后發(fā)現(xiàn)液面低于刻度線�����,再用膠頭滴管加水至刻度線造成溶液的實際體積偏大,故c偏小����。
答案:(1)偏大 (2)偏小 (3)無影響 (4)偏大
(5)偏大 (6)偏小
活動與探究2:解析:(1)設(shè)濃硫酸的體積為1 L
則濃硫酸中硫酸的物質(zhì)的量為n(H2SO4)==18.4 mol
濃硫酸的物質(zhì)的量濃度為c(H2SO4)=n(H2SO4)/V[H2SO4(aq)]=18.4 mol·L-1
(2)根據(jù)稀釋前后溶質(zhì)的質(zhì)量(物質(zhì)的量)相等,可得
V(H2SO4)×1.84 g·cm-3×98%=0.5 L×1 mol·L
10�����、-1×98 g·mol-1
解得V(H2SO4)=27.2 mL
答案:(1)18.4 mol·L-1 (2)27.2 mL
思考與交流:答案:Na2O溶于水并和水發(fā)生反應(yīng):Na2O+H2O===2NaOH����,根據(jù)方程式可知0.1 mol Na2O溶于水得到0.2 mol NaOH,故所得溶液的物質(zhì)的量濃度為0.2 mol·L-1����。
當(dāng)堂檢測
1.C 解析:定容時�,視線應(yīng)與刻度線相平。
2. B 解析:A中1 L該溶液中含有NaOH質(zhì)量不是40 g��,而是4 g�;C中從1 L該溶液中取出100 mL,所取溶液的濃度不變��,仍為0.1 mol·L-1��;溶解4 g NaOH的溶液不再是1 L
11、了�����。
3.D 解析:0.1 mol·L-1 NaCl溶液中Cl-物質(zhì)的量濃度是0.1 mol·L-1�����;0.1 mol·L-1 MgCl2溶液中Cl-物質(zhì)的量濃度是0.2 mol·L-1���;0.1 mol·L-1 AlCl3溶液中Cl-物質(zhì)的量濃度是0.3 mol·L-1����,故選D�。
4.解析:實驗室中沒有230 mL的容量瓶,所以應(yīng)該選用250 mL的容量瓶來配制250 mL 1 mol·L-1的NaOH溶液��,所以所需NaOH的質(zhì)量為m(NaOH)=n(NaOH)·M(NaOH)=0.25 L×40 g·mol-1=10 g�。進(jìn)行誤差分析時根據(jù)c=即可,配制物質(zhì)的量濃度一定的溶液時���,只要溶質(zhì)外灑或加水過多���,則必須重新配制��。
答案:10.0 1~2 cm 膠頭滴管
(1)①②④③⑥⑤
(2)C
(3)①偏低?����、谄汀����、燮?
(4)①不用處理?��、谥匦屡渲?
 遼寧省凌海市高中化學(xué) 第1章 認(rèn)識化學(xué)科學(xué) 第3節(jié) 化學(xué)中常用的物理量——物質(zhì)的量(第3課時)學(xué)案魯科版必修1
遼寧省凌海市高中化學(xué) 第1章 認(rèn)識化學(xué)科學(xué) 第3節(jié) 化學(xué)中常用的物理量——物質(zhì)的量(第3課時)學(xué)案魯科版必修1