《陶瓷材料結(jié)構(gòu)及性能分類新結(jié)構(gòu)陶瓷材料科學(xué)基礎(chǔ).ppt》由會員分享����,可在線閱讀,更多相關(guān)《陶瓷材料結(jié)構(gòu)及性能分類新結(jié)構(gòu)陶瓷材料科學(xué)基礎(chǔ).ppt(55頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
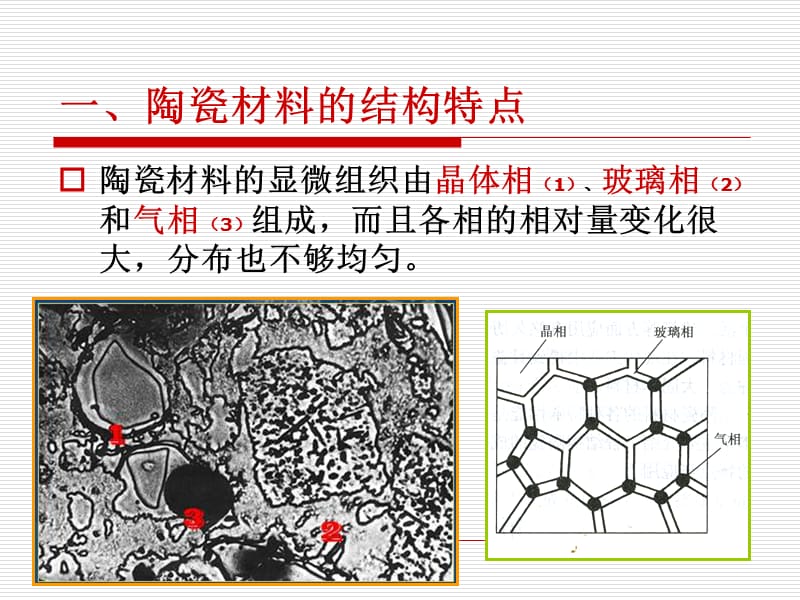
1����、一、陶瓷材料的結(jié)構(gòu)特點,陶瓷材料的顯微組織由晶體相(1)���、玻璃相(2)和氣相(3)組成����,而且各相的相對量變化很大�����,分布也不夠均勻。,(一)���、陶瓷晶體,晶相是陶瓷材料中主要的組成相��,決定陶瓷材料物理化學(xué)性質(zhì)的主要是晶相��。 由于陶瓷材料中原子的鍵合方式主要是離子鍵�����,故多數(shù)陶瓷的晶體結(jié)構(gòu)可以看成是由帶電的離子而不是由原子組成���。 由于陶瓷至少由兩種元素組成,所以陶瓷的晶體結(jié)構(gòu)通常要比純金屬的晶體結(jié)構(gòu)復(fù)雜。,��、陶瓷晶體中正�、負離子的堆積方式:,在離子(陶瓷)晶體中正���、負離子的堆積方式取決于以下兩個因素: 正負離子的電荷大?。壕w必須保持電中性,(所有正離子的正電荷應(yīng)等于所有負離子的負電荷) 正負離子的相
2�、對大小: 由于正負離子的外層電子形成封閉的殼層,因此可將離子簡化為具有一定半徑的剛性球體�。,,在離子晶體中,一些原子失去最外層電子而變成正離子����,另一些原子則得到最外層電子而成為負離子。因此�����,在離子晶體中����,通常正離子小于負離子,即: rc/rA <1 rc和rA分別代表正負離子的半徑��。 一些正負離子的半徑,如表3-1所示,,,,為了降低晶體的總能量���,正����、負離子趨于形成盡可能緊密的堆積. 即:一個正離子趨于有盡可能多的負離子為鄰。一個正離子周圍的最近鄰負離子數(shù)稱為配位數(shù)。 因此���,一個最穩(wěn)定的結(jié)構(gòu)應(yīng)當有盡可能大的配位數(shù),而這個配位數(shù)又取決于正�、負離子的
3、半徑之比�。 圖,,,,由圖可知只有當rc/rA 等于或大于某一(最小)臨界值后���,某一給定的配位數(shù)結(jié)構(gòu)才是穩(wěn)定的�。 這個臨界值就是當正離子與它周圍的負離子相切��,而且這些負離子也彼此相切時���,正��、負離子直徑的半徑比��。 表,,,,以上關(guān)于臨界離子半徑比值的概念完全是從幾何角度考慮的��,對于許多離子晶體很有效���。 但也有例外情況�����,即配位數(shù)有時可大于離子半徑比值所允許的數(shù)值。 這是由于以上中把離子看成剛性球體����。 而實際上正離子周圍的負離子可以通過變形使配位數(shù)增大,另外�����,化合物中具有方向性的共價鍵也會起類似的作用��。(舉例說明書),,CsCl晶胞圖: Cl-離子按簡單立方結(jié)構(gòu)排列����,正離子Cs+位于立方體的間隙。由
4�����、于正負離子數(shù)相等��,所以立方體的間隙都是填滿的����。 致密度和晶格常數(shù)的計算: 配位數(shù):8 所有立方體間隙都是添滿的 不是體心立方,是簡單立方的,,Cl-,Cs+,,陶瓷材料的成分是多種多樣的��,從簡單的化合物到由多種復(fù)雜的化合物構(gòu)成的混合物。 陶瓷材料的主要成分是氧化物��、碳化物��、氮化物����、硅化物等。,2����、常見陶瓷晶體類型,AX型陶瓷晶體 (1)CsCl型 (2)NaCl型 (3) ZnS閃鋅礦型結(jié)構(gòu) (4)纖維鋅礦型結(jié)構(gòu) AmXp型陶瓷晶體 (1)螢石(CaF2)型結(jié)構(gòu)與逆螢石型結(jié)構(gòu) (2)剛玉(Al2O3)結(jié)構(gòu) (以下分別介紹),AX型陶瓷晶體,AX型陶瓷晶體是最簡單的陶瓷化合物, 它們具有數(shù)量相等
5�、的金屬原子和非金屬原子。 它們可以是離子型化合物���,如MgO�����,其中兩個電子從金屬原子轉(zhuǎn)移到非金屬原子�����,而形成陽離子(Mg2+)和陰離子(O2)�。 AX化合物也可以是共價型�,價電子在很大程度上是共用的。硫化鋅(ZnS)是這類化合物的一個例子��。,,AX化合物的特征是:A和X原子或離子是高度有序的����,屬于這類結(jié)構(gòu)的有: (1)CsCl型 (2)NaCl型 (3) ZnS閃鋅礦型 (4)纖維鋅礦型 (以下分別介紹),,(1)CsCl型 這種化合物的結(jié)構(gòu)見圖3-2。A原子(或離子)位于8個X原子的中心�,X原子(或離子)也處于8個A原子的中心。但應(yīng)該注意的是���,這種結(jié)構(gòu)
6��、并不是體心立方的����。確切的說�����,它是簡單立方的�,它相當于把簡單立方的A原子和X原子晶格相對平移a/2,到達彼此的中心位置而形成���。,,,(2)NaCl型,NaCl型的結(jié)構(gòu)是: 負離子Cl-為面心立方點陣���;而正離子Na+位于其晶胞和棱邊的中心(八面體間隙位置)����。其原子排列情況所示�����。每個Na+周圍有六個Cl-��,即配位數(shù)為6�。,,,空心圓為Na+,實心圓為Cl-,(3) 閃鋅礦型結(jié)構(gòu):,這類結(jié)構(gòu)原子排列屬于面心立方空間點陣�����。 一種原子占據(jù)點陣結(jié)點���,另一種原子占據(jù)四面體間隙的一半�����。該晶體結(jié)構(gòu)基本上為共價鍵�����,Zn����、S原子的配位數(shù)都為4�。 形成的陶瓷材料很硬很脆。 許多半導(dǎo)體化合物屬于此類結(jié)構(gòu)���。 屬于閃鋅礦型結(jié)
7��、構(gòu)的陶瓷材料有ZnS����、高溫下的BeO等�;,,(4)纖維鋅礦型結(jié)構(gòu):,屬于簡單六方空間點陣。 一種原子占據(jù)點陣結(jié)點�,另一種原子占據(jù)四面體間隙的一半。Zn�����、S原子的配位數(shù)都為4�。 屬于這類結(jié)構(gòu)的陶瓷材料有BeO �、ZnO等�����。,,AmXp型陶瓷晶體,(1)螢石(CaF2)型結(jié)構(gòu)與逆螢石型結(jié)構(gòu): 螢石(CaF2)型結(jié)構(gòu): 鈣離子(Ca+)位于點陣的結(jié)點位置��,氟離子()填滿所有四面體的間隙(八面體全空) 如UO2可做核燃料����,而核裂變的產(chǎn)物可留在這些空間處。,,逆螢石型結(jié)構(gòu): 如果負離子位于點陣的結(jié)點位置��,正離子填滿所有四面體的間隙(八面體全空)���,這樣結(jié)構(gòu)中正���、負離子的配置與正常的CaF2結(jié)構(gòu)剛好相反,因
8�����、此��,稱為反CaF2結(jié)構(gòu)(逆螢石型結(jié)構(gòu))。 具有這種結(jié)構(gòu)的氧化物有:Li2O�,Na2O, K2O�。,(2)剛玉(Al2O3)結(jié)構(gòu),這種結(jié)構(gòu)的氧離子(負離子)具有密排六方的排列,正離子占據(jù)八面體間隙的三分之二���。,具有這種結(jié)構(gòu)的氧化物有:Al2O3���、Fe2O3�、Cr2O3、Ti2O3�、V2O3、Ga2O3�����、Rh2O3等�����。 (Ga鎵�、Rh銠),其它:,尖晶石型結(jié)構(gòu)(AB2O4)(書P51) 正常尖晶石型結(jié)構(gòu) 反尖晶石型結(jié)構(gòu)(較多見) 這類化合物是重要的非金屬磁性材料, 鈣鈦礦型結(jié)構(gòu): 這類結(jié)構(gòu)對壓電材料很重要�。,壓電效應(yīng):,物質(zhì)在受機械壓縮或拉伸變形時,在它們兩對面的界面上將產(chǎn)生一定的電荷,形成一定
9�、的電勢。反之����,在它們的兩界面上加以一定的電壓,則將產(chǎn)生一定的機械變形����,這一現(xiàn)象稱為壓電效應(yīng)。(超聲加工中應(yīng)用),��、硅酸鹽化合物,許多陶瓷材料都包含硅酸鹽���,一方面是因為硅酸鹽豐富和便宜���,另一方面則是因為它們具有在工程上有用的某些獨特性能。 工程建筑材料中的玻璃��、硅酸鹽水泥��、和磚等���。 另外����,許多重要的電絕緣材料也是由硅酸鹽制成的。,(1) 硅酸鹽四面體單元,硅酸鹽的基本結(jié)構(gòu)單元為硅酸根(SiO44) 四面體�����。 其中�����,四面體的頂角上有四個氧原子�����,四面體的中間間隙位置上有一個硅原子���。 將四面體連接在一起的力包含離子鍵和共價鍵(這是Si-O鍵的性質(zhì)所決定的,其中大約40%為離子鍵)�����;因此�,四面體的結(jié)合很
10、牢固���。 各四面體單元之間通常只在頂角之間以不同方式連接�,而很少在棱邊之間連接。,,(2) 硅酸鹽化合物的幾種類型,按照連接方式劃分���,硅酸鹽化合物可以分為以下幾種類型: 孤立狀硅酸鹽復(fù)合狀硅酸鹽環(huán)狀或鏈狀硅酸鹽層狀硅酸鹽 立體網(wǎng)絡(luò)狀硅酸鹽,孤立狀硅酸鹽(島狀結(jié)構(gòu)單元),其單元體(SiO44)互相獨立�,不發(fā)生相互連接���。 化學(xué)組成一般可以表示為2ROSiO2��。 其中RO表示金屬氧化物如MgO�����、CaO�、FeO等�����。 具有這類結(jié)構(gòu)的有橄欖石和石榴石等����。,,復(fù)合狀硅酸鹽(雙四面體結(jié)構(gòu)單元),由兩個(SiO44)單元體連接在一起,可能有的連接方式很多�,其中最簡單的方式如圖所示��。 屬于這類結(jié)構(gòu)的有鎂方柱石�����、C
11�����、a2MgSi2O7(黃長石)等����。,,(3)環(huán)狀或鏈狀硅酸鹽,(SiO44)四面體的兩個頂點(氧離子)為相鄰兩個四面體所共有時���,形成各種環(huán)狀或鏈狀結(jié)構(gòu)���。 這類硅酸鹽結(jié)構(gòu)的化學(xué)組成可以表示為ROSiO2����。 具有環(huán)狀類結(jié)構(gòu)的硅酸鹽: 藍錐石和綠柱石(書) 具有鏈狀類結(jié)構(gòu)的硅酸鹽:輝石 如:頑輝石(MgSiO3)、透輝石MgCa(SiO3)2���; 透閃石(OH���,F(xiàn))2Ca2Mg5Si8O22等�����。,,層狀硅酸鹽,此類結(jié)構(gòu)中��,四面體具有三個共有頂點(氧離子) �,構(gòu)成了二維網(wǎng)絡(luò)的層狀結(jié)構(gòu)����。 化學(xué)組成可以表示為RO2SiO2。 通常粘土礦物����、云母礦、滑石礦具有這種結(jié)構(gòu)����。,,立體網(wǎng)絡(luò)狀硅酸鹽,若硅氧四面體中
12、的四個頂點均共有�����,則形成立體網(wǎng)絡(luò)結(jié)構(gòu)��。 具有這類結(jié)構(gòu)的硅酸鹽有石英(SiO2)等。 (書),(二)����、玻璃相,玻璃相的作用是充填晶粒間隙、粘結(jié)晶粒�、提高材料致密度、降低燒結(jié)溫度和抑制晶粒長大����。 玻璃相產(chǎn)生過程:熔融液相冷卻時在玻璃轉(zhuǎn)變溫度粘度增大到一定程度時, 熔體硬化,轉(zhuǎn)變?yōu)椴AА?玻璃相結(jié)構(gòu)特點:硅氧四面體組成不規(guī)則的空間網(wǎng), 形成玻璃的骨架��。 玻璃相成分:氧化硅和其它氧化物,(三)����、氣相,氣相是陶瓷內(nèi)部殘留的孔洞;成因復(fù)雜��,影響因素多�����。 陶瓷根據(jù)氣孔率分致密陶瓷���、無開孔陶瓷和多孔陶瓷�����。 氣孔對陶瓷的性能不利(多孔陶瓷除外) 氣孔率:普通陶瓷5%10 特種陶瓷5以下 金屬陶瓷低于0.5����。,二
13��、��、陶瓷材料的分類,1����、按化學(xué)成分分類 可將陶瓷材料分為氧化物陶瓷、碳化物陶瓷�����、氮化物陶瓷及其它化合物陶瓷��。,,2�����、按使用的原材料分類 可將陶瓷材料分為普通陶瓷和特種陶瓷���。,普通陶瓷以天然的巖石���、礦石����、黏土等材料作原料��。 特種陶瓷采用人工合成的材料作原料���。 3���、按性能和用途分類 可將陶瓷材料分為結(jié)構(gòu)陶瓷和功能陶瓷兩類。,陶瓷零件,三�����、常用工業(yè)陶瓷,工程陶瓷的生產(chǎn)過程:原料制備�、坯料成形和制品燒成或燒結(jié)。 原料制備 將礦物原料經(jīng)揀選��、粉粹后配料�、混合、磨細等得到坯料。 坯料成形 將坯料加工成一定形狀和尺寸并有必要機械強度和致密度的半成品��。包括可塑成形(如傳統(tǒng)陶瓷)�����,注漿成形(如形狀復(fù)雜�����、精度要求高
14���、的普通陶瓷)和壓制成形(如特種陶瓷和金屬陶瓷) 干燥后的坯料加熱到高溫,進行一系列的物理�����、化學(xué)變化而成瓷的過程��。燒成是使坯件瓷化的工藝(12501450)���;燒結(jié)是指燒成的制品開口氣孔率極低���、而致密度很高的瓷化過程。,,(一)普通陶瓷 普通陶瓷是用粘土(Al2O32SiO22H2O)、長石(K2OAl2O36SiO2��,Na2OAl2O36SiO2)和石英(SiO2)為原料���,經(jīng)成型����、燒結(jié)而成的陶瓷��。 其組織中主晶相為莫來石(3Al2O32SiO2)����,占2530%,玻璃相占3560%���,氣相占13%��。,普通陶瓷加工成型性好��,成本低�,產(chǎn)量大���。 除日用陶瓷��、瓷器外��,大量用于電器�����、化工�����、建筑����、紡織等工業(yè)部門
15����、。,(二)新型結(jié)構(gòu)陶瓷, 氧化鋁陶瓷 氧化鋁陶瓷以Al2O3為主要成分, 含有少量SiO2的陶瓷���,又稱高鋁陶瓷�����。,單相Al2O3陶瓷組織,根據(jù)Al2O3含量不同分為75瓷(含75%Al2O3�,又稱剛玉-莫來石瓷)、95瓷和99瓷��,后兩者又稱剛玉瓷��。 氧化鋁陶瓷耐高溫性能好����,可使用到1950,。具有良好的電絕緣性能及耐磨性�����。微晶剛玉的硬度極高(僅次于金剛石).,氧化鋁陶瓷被廣泛用作耐火材料�,如耐火磚、坩堝��、,熱偶套管����,淬火鋼的切削刀具、金屬拔絲模�����,內(nèi)燃機的火花塞�����,火箭、導(dǎo)彈的導(dǎo)流罩及軸承等���。, 氮化硅(Si3N4)陶瓷 氮化硅是由Si3N4四面體組成的共 價鍵固體����。 氮化硅的制備與燒結(jié)工藝 工
16����、業(yè)硅直接氮化:3Si+2N2Si3N4 二氧化硅還原氮化: 3SiO2+6C+2N2Si3N4+6CO, 性能特點及應(yīng)用 氮化硅的強度高���;硬度僅次于金剛石���、碳化硼等;摩擦系數(shù)僅為0.10.2�;熱膨脹系數(shù)小�;抗熱震性大大高于其他陶瓷材料;化學(xué)穩(wěn)定性高��。,熱壓燒結(jié)氮化硅用于形狀簡單�����、精度要求不高的零件,如切削刀具�、高溫軸承等。,Si3N4軸承,反應(yīng)燒結(jié)氮化硅用于形狀復(fù)雜����、尺寸精度要求高的零件,如機械密封環(huán)等�。, 碳化硅(SiC)陶瓷 碳化硅是通過鍵能很高的共價鍵結(jié)合的晶體。 碳化硅是用石英沙(SiO2)加焦碳直接加熱至高溫還原而成: SiO2+3CSiC+2CO�����。,碳化硅的燒
17��、結(jié)工藝也有熱壓和反應(yīng)燒結(jié)兩種���。由于碳化硅表面有一層薄氧化膜��,因此很難燒結(jié)�,需添加燒結(jié)助劑促進燒結(jié)�����,常加的助劑有硼、碳�、鋁等。,常壓燒結(jié)碳化硅,碳化硅的最大特點是高溫強度高����,有很好的耐磨損、耐腐蝕���、抗蠕變性能�����,其熱傳導(dǎo)能力很強���,僅次于氧化鈹陶瓷��。,碳化硅陶瓷用于制造火箭噴嘴�����、澆注金屬的喉管���、熱電偶套管����、爐管、燃氣輪機葉片及軸承��,泵的密封圈��、拉絲成型模具等��。, 氧化鋯陶瓷 氧化鋯的晶型轉(zhuǎn)變:立方相四方相單斜相���。四方相轉(zhuǎn)變?yōu)閱涡毕喾浅Q杆?����,引起很大的體積變化�,易使制品開裂�����。,,在氧化鋯中加入某些氧化物(如CaO���、MgO�、Y2O3等)能形成穩(wěn)定立方固溶體,不再發(fā)生相變��,具有這種結(jié)構(gòu)的氧化鋯稱為完全穩(wěn)定
18�����、氧化鋯(FSZ)���,其力學(xué)性能低��,抗熱沖擊性差�。,,ZrO2陶瓷耐火件,,減少加入的氧化物數(shù)量��,使部分氧化物以四方相的形式存在��。由于這種材料只使一部分氧化鋯穩(wěn)定�,所以稱部分穩(wěn)定氧化鋯(PSZ)。,,部分穩(wěn)定氧化鋯組織,部分穩(wěn)定氧化鋯的導(dǎo)熱率低��,絕熱性好�����;熱膨脹系數(shù)大��,接近于發(fā)動機中使用的金屬�,抗彎強度與斷裂韌性高,除在常溫下使用外�����,已成為絕熱柴油機的主要侯選材料����,如發(fā)動機汽缸內(nèi)襯、推桿�����、活塞帽�����、閥座�����、凸輪����、軸承等。,部分穩(wěn)定氧化鋯制品,,氧化鋯中四方相向單斜相的轉(zhuǎn)變可通過應(yīng)力誘發(fā)產(chǎn)生。當受到外力作用時����,這種相變將吸收能量而使裂紋尖端的應(yīng)力場松弛,增加裂紋擴展阻力���,從而大幅度提高陶瓷材料的韌性����。,,氧化鋯制品,
 陶瓷材料結(jié)構(gòu)及性能分類新結(jié)構(gòu)陶瓷材料科學(xué)基礎(chǔ).ppt
陶瓷材料結(jié)構(gòu)及性能分類新結(jié)構(gòu)陶瓷材料科學(xué)基礎(chǔ).ppt