《高中化學(xué)二放熱反應(yīng)與吸熱反應(yīng)比較歸類總結(jié)知識點(diǎn)選修4》由會員分享����,可在線閱讀����,更多相關(guān)《高中化學(xué)二放熱反應(yīng)與吸熱反應(yīng)比較歸類總結(jié)知識點(diǎn)選修4(1頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
類型
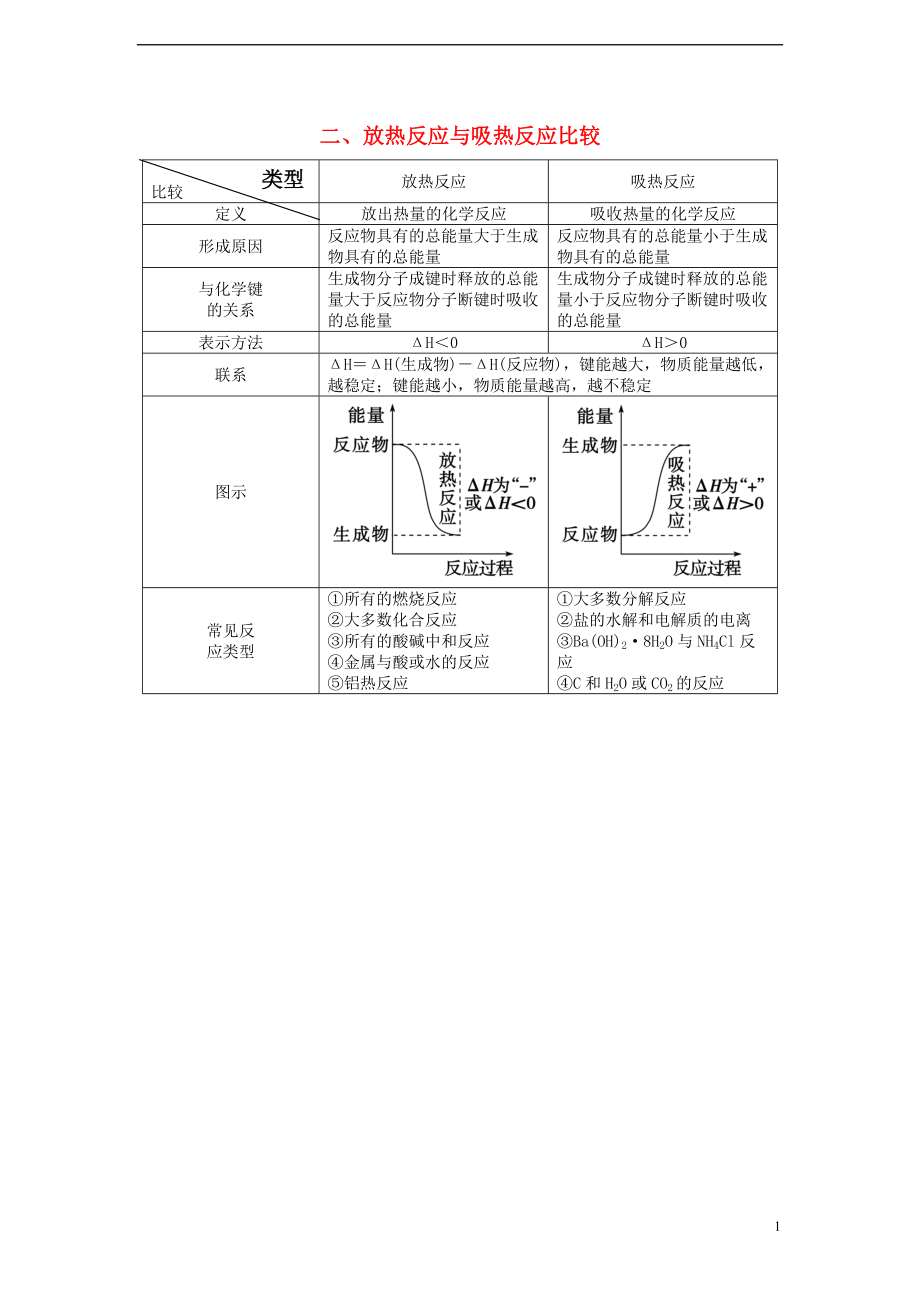
二��、放熱反應(yīng)與吸熱反應(yīng)比較
比較
放熱反應(yīng)
吸熱反應(yīng)
定義
放出熱量的化學(xué)反應(yīng)
吸收熱量的化學(xué)反應(yīng)
形成原因
反應(yīng)物具有的總能量大于生成物具有的總能量
反應(yīng)物具有的總能量小于生成物具有的總能量
與化學(xué)鍵
的關(guān)系
生成物分子成鍵時釋放的總能量大于反應(yīng)物分子斷鍵時吸收的總能量
生成物分子成鍵時釋放的總能量小于反應(yīng)物分子斷鍵時吸收的總能量
表示方法
ΔH<0
ΔH>0
聯(lián)系
ΔH=ΔH(生成物)-ΔH(反應(yīng)物)���,鍵能越大�,物質(zhì)能量越低��,越穩(wěn)定;鍵能越小,物質(zhì)能量越高��,越不穩(wěn)定
圖示
常見反
應(yīng)類型
①所有的燃燒反應(yīng)
②大多數(shù)化合反應(yīng)
③所有的酸堿中和反應(yīng)
④金屬與酸或水的反應(yīng)
⑤鋁熱反應(yīng)
①大多數(shù)分解反應(yīng)
②鹽的水解和電解質(zhì)的電離
③Ba(OH)28H2O與NH4Cl反應(yīng)
④C和H2O或CO2的反應(yīng)
1
 高中化學(xué)二放熱反應(yīng)與吸熱反應(yīng)比較歸類總結(jié)知識點(diǎn)選修4
高中化學(xué)二放熱反應(yīng)與吸熱反應(yīng)比較歸類總結(jié)知識點(diǎn)選修4