《2022年秋高中化學(xué) 初高中銜接 專(zhuān)題21 硫及其氧化物學(xué)案》由會(huì)員分享��,可在線閱讀���,更多相關(guān)《2022年秋高中化學(xué) 初高中銜接 專(zhuān)題21 硫及其氧化物學(xué)案(8頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1����、2022年秋高中化學(xué) 初高中銜接 專(zhuān)題21 硫及其氧化物學(xué)案
【知識(shí)回放】
1.請(qǐng)寫(xiě)出硫原子結(jié)構(gòu)示意圖。
2.結(jié)合初中學(xué)習(xí)的硫單質(zhì)性質(zhì)���,歸納總結(jié)出硫單質(zhì)的物理性質(zhì)����。
3.硫單質(zhì)在空氣中與純氧中燃燒現(xiàn)象分別是什么��?
【答案】
1.
2.淡黃色晶體�����,不溶于水,微溶于酒精����,易溶于二硫化碳
3.空氣中:淡藍(lán)色火焰,純氧中:藍(lán)紫色火焰
【新知精講】
一��、硫(S)
存在
游離態(tài)
存在于火山噴口或地殼的巖層里
化合態(tài)
主要以硫化物和硫酸鹽的形式存在
重要的化合物
名稱(chēng)
硫鐵礦
芒硝
黃銅礦
石膏
化學(xué)式
FeS2
Na2SO4·10H2O
CuFeS2
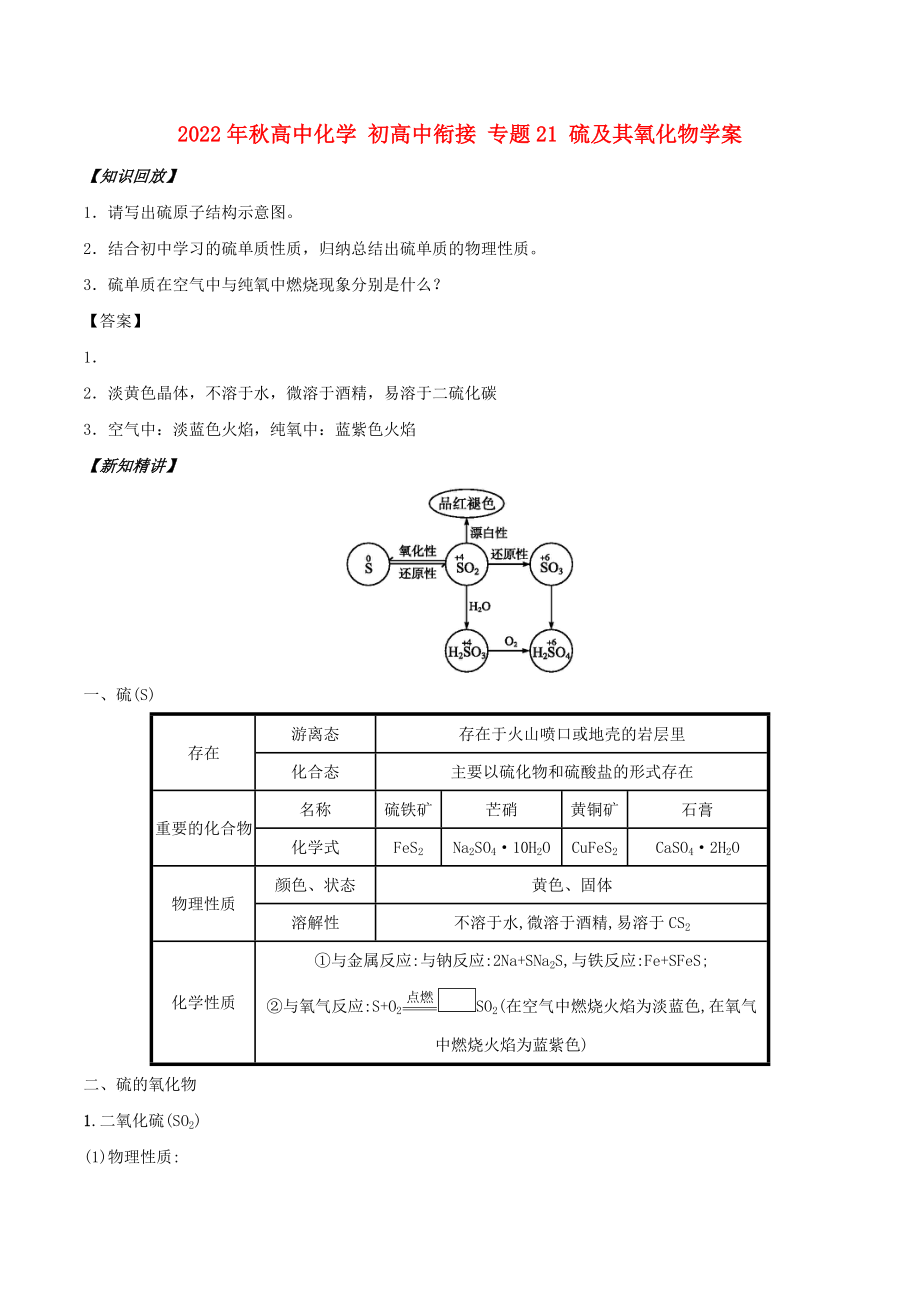
2��、
CaSO4·2H2O
物理性質(zhì)
顏色���、狀態(tài)
黃色��、固體
溶解性
不溶于水,微溶于酒精,易溶于CS2
化學(xué)性質(zhì)
①與金屬反應(yīng):與鈉反應(yīng):2Na+SNa2S,與鐵反應(yīng):Fe+SFeS;
②與氧氣反應(yīng):S+O2點(diǎn)燃
=
SO2(在空氣中燃燒火焰為淡藍(lán)色,在氧氣中燃燒火焰為藍(lán)紫色)
二����、硫的氧化物
1.二氧化硫(SO2)
(1)物理性質(zhì):
顏色
狀態(tài)
氣味
密度
溶解性
無(wú)色
氣體
刺激性氣味
比空氣的大
易溶于水
(2)化學(xué)性質(zhì):
①與H2O反應(yīng):SO2+H2OH2SO3���。②與NaOH反應(yīng):SO2+2NaOH===Na2SO3+H2O�。
③與
3�、CaO反應(yīng):SO2+CaO===CaSO3。④與O2反應(yīng):2SO2+O22SO3�。
2.三氧化硫
三氧化硫具有酸性氧化物的通性,主要反應(yīng)如下:
SO3
【科學(xué)探究】
探究一 各類(lèi)漂白劑的漂白原理
· 問(wèn)題導(dǎo)引
1.分別將SO2和Cl2通入品紅溶液中并加熱,現(xiàn)象有何不同?若分別通入紫色石蕊溶液中呢?
2.把SO2和Cl2同時(shí)通入溶液中,溶液的漂白性是“強(qiáng)強(qiáng)聯(lián)合”嗎?
提示若將等物質(zhì)的量的Cl2和SO2氣體相混合后,在溶液中發(fā)生反應(yīng):SO2+Cl2+2H2O===H2SO4+2HCl,從而失去漂白能力。
探究二 二氧化硫與二氧化碳的鑒別����、凈化及檢驗(yàn)
問(wèn)題導(dǎo)引
SO2
4�����、與CO2性質(zhì)的異同:
1.CO2和SO2均為酸性氧化物,在性質(zhì)上具有一定的相似性,結(jié)合已有的知識(shí)探究能否用澄清石灰水鑒別CO2和SO2,為什么?
提示不能用澄清石灰水鑒別SO2和CO2,因?yàn)槎咄ㄈ氤吻迨宜畷r(shí),現(xiàn)象相同,即開(kāi)始產(chǎn)生白色沉淀,后來(lái)沉淀溶解消失�。
2.若要證明某氣體是CO2和SO2的混合氣體,需用哪些試劑?順序如何確定?
漂白類(lèi)型
漂白原理
特點(diǎn)
舉例
氧化型
漂白劑本身是強(qiáng)氧化劑,利用其氧化性氧化有色物質(zhì)而使之失去原有的顏色
不可逆,褪色后不能恢復(fù)原色
HClO�、Ca(ClO)2、Na2O2�����、H2O2等
化合型
漂白劑與有色物質(zhì)結(jié)合生成新的
5��、無(wú)色物質(zhì),使有機(jī)色質(zhì)失去原有的顏色
可逆,在一定的條件下又能恢復(fù)原來(lái)的顏色
SO2使品紅褪色
吸附型
有些固體物質(zhì)疏松�、多孔,具有較大的表面積,可以吸附有色物質(zhì)而使之失去原有的顏色
部分吸附劑可重復(fù)使用
活性炭�����、木炭
【重點(diǎn)突破】
1.漂白原理分類(lèi)
特別提醒
(1)漂白是有機(jī)色素失去原有顏色的過(guò)程,可能發(fā)生化學(xué)反應(yīng),如氧化型和化合型,也可能不發(fā)生化學(xué)反應(yīng),如吸附型�����。
(2)Na2O2雖具有漂白性,但它生成的NaOH有較強(qiáng)的腐蝕性,所以一般不用它作漂白劑���。
2.SO2的漂白性
(1)SO2的漂白具有選擇性,可以漂白品紅溶液,以及棉���、麻等物品,但不能漂白酸堿指示劑,如石蕊
6�����、�、酚酞等�����。
(2)SO2能使溴水�����、酸性KMnO4溶液褪色,是因?yàn)镾O2的還原性而非漂白性���。
(3)利用氯水����、SO2的漂白性,可以鑒別Cl2和SO2,方法是將氣體分別通入品紅溶液,品紅溶液均褪色,然后再加熱褪色后的溶液,恢復(fù)紅色的通入的是SO2,不恢復(fù)原來(lái)紅色的通入的是Cl2���。
3.SO2和CO2的性質(zhì)比較
SO2
CO2
物理性質(zhì)
氣味
有刺激性氣味
無(wú)味
毒性
有毒
無(wú)毒
溶解性
易溶(體積比1∶40)
可溶(體積比1∶1)
化學(xué)性質(zhì)
與水的反應(yīng)
SO2+H2OH2SO3
CO2+H2OH2CO3
與堿的反應(yīng)
SO2氣體通入澄清石灰水中,先生成沉
7��、淀,當(dāng)氣體過(guò)量時(shí)沉淀又溶解:Ca(OH)2+SO2===CaSO3↓+H2O
CaSO3+SO2+H2O===Ca(HSO3)2
CO2氣體通入澄清石灰水中,先生成沉淀,當(dāng)氣體過(guò)量時(shí)沉淀又溶解:Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
與堿性氧化物反應(yīng)
SO2+CaO===CaSO3
CO2+CaO===CaCO3
弱氧化性
SO2+2H2S===3S↓+2H2O
CO2+C2CO
還原性
二氧化硫能被酸性高錳酸鉀溶液���、氯水���、溴水、碘水等氧化劑氧化
無(wú)
漂白性
有,不穩(wěn)定
無(wú)
對(duì)環(huán)境的影響
形成酸雨
8����、
引起溫室效應(yīng)
鑒別
①利用二氧化硫的還原性,能使酸性高錳酸鉀溶液或溴水褪色的是二氧化硫
②利用二氧化硫的漂白性,用品紅溶液鑒別
4.SO2和CO2鑒別方法的辨析
二氧化硫和二氧化碳都能使澄清石灰水變渾濁,若通入的氣體過(guò)量,則沉淀都可消失。所以不能用澄清石灰水來(lái)鑒別二氧化硫和二氧化碳�����。通?���?捎靡韵路椒?
(1)用品紅溶液,使品紅溶液褪色的是二氧化硫,不能使品紅溶液褪色的是二氧化碳�����。
(2)用氫硫酸,出現(xiàn)渾濁的是二氧化硫,無(wú)明顯現(xiàn)象的是二氧化碳��。
2H2S+SO2===2H2O+3S↓
(3)用酸性高錳酸鉀溶液,紫色褪去的是二氧化硫,無(wú)明顯現(xiàn)象的是二氧化碳�。
2KMnO4+5
9����、SO2+2H2O===K2SO4+2MnSO4+2H2SO4
(4)用溴水,使橙色褪去的是二氧化硫,無(wú)明顯現(xiàn)象的是二氧化碳�。
Br2+2H2O+SO2===2HBr+H2SO4
(5)用硝酸酸化的硝酸鋇溶液,產(chǎn)生白色沉淀的是二氧化硫,無(wú)明顯現(xiàn)象的是二氧化碳。
2HNO3+3SO2+2H2O===3H2SO4+2NO
Ba(NO3)2+H2SO4===BaSO4↓+2HNO3
(6)用FeCl3溶液,使溶液顏色變淺的是二氧化硫,無(wú)明顯現(xiàn)象的是二氧化碳����。
2FeCl3+SO2+2H2O===FeCl2+FeSO4+4HCl
【典題探究】
典例1
某化學(xué)實(shí)驗(yàn)小組的同學(xué)為探究和比較
10、SO2和氯水的漂白性,設(shè)計(jì)了如下的實(shí)驗(yàn)裝置����。
(1)實(shí)驗(yàn)室用裝置A制備SO2。某同學(xué)在實(shí)驗(yàn)時(shí)發(fā)現(xiàn)打開(kāi)A的分液漏斗活塞后,漏斗中液體未流下,你認(rèn)為原因可能是 ;?
(2)實(shí)驗(yàn)室用裝置E制備Cl2,其反應(yīng)的化學(xué)方程式MnO2+4HCl(濃) MnCl2+Cl2↑+2H2O����。若有6 mol的HCl參加反應(yīng),則轉(zhuǎn)移的電子總數(shù)為 ;?
(3)①反應(yīng)開(kāi)始一段時(shí)間后,觀察到B、D兩個(gè)試管中的品紅溶液出現(xiàn)的現(xiàn)象是:B: ,?D: ;?
②停止通氣后,再給B��、D兩個(gè)試管分別加熱,兩個(gè)試管中的現(xiàn)象分別為:B: ,
11����、?D: 。?
【答案】:(1)分液漏斗的玻璃塞沒(méi)有取下來(lái)
(2)3×6.02×1023 (3)①品紅褪色 品紅褪色
②褪色的品紅溶液又恢復(fù)成紅色 無(wú)明顯現(xiàn)象
變式訓(xùn)練1
SO2通入下列溶液中,溶液褪色或顏色變淺,說(shuō)明SO2具有漂白作用的組合是( )
①酸性KMnO4溶液?����、诼人、跢e3+(aq)?、芷芳t溶液
A.①② B.②③ C.④ D.都不是
【答案】:C
【解析】:SO2具有漂白性,其漂白原理為SO2與有色物質(zhì)化合,生成不穩(wěn)定的無(wú)色物質(zhì),受熱后能恢復(fù)原來(lái)顏色。SO2具有還原性,能與氧化性的物質(zhì)Fe3+����、酸性KMnO4溶
12、液����、氯水發(fā)生氧化還原反應(yīng),因而①②③均不能說(shuō)明SO2具有漂白性。
典例2
某化學(xué)興趣小組為了探究常溫下某非金屬氧化物形成的未知?dú)怏w的成分�����。該小組成員將氣體通入澄清石灰水,發(fā)現(xiàn)澄清石灰水變渾濁,持續(xù)通入發(fā)現(xiàn)渾濁又變澄清,由此該小組成員對(duì)氣體的成分提出猜想��。
【提出猜想】
猜想1:該氣體為CO2
猜想2:該氣體為SO2
猜想3:?
為了驗(yàn)證猜想,該小組設(shè)計(jì)實(shí)驗(yàn)加以探究:
【實(shí)驗(yàn)探究】
該小組同學(xué)按如圖所示裝置,將氣體從a端通入,則:
(1)B中應(yīng)該裝下列 試劑(填編號(hào))�。?
A.NaCl溶液 B.酸性KMnO4溶液
C.鹽酸 D.澄清
13、石灰水
(2)A中品紅溶液的作用是 �����。?
(3)D中澄清石灰水的作用是 ���。?
通過(guò)實(shí)驗(yàn),該小組同學(xué)觀察到以下三個(gè)實(shí)驗(yàn)現(xiàn)象:
①A中品紅溶液褪色②C中品紅溶液不褪色③D中澄清石灰水變渾濁
【得出結(jié)論】
(4)由上述現(xiàn)象該小組同學(xué)確認(rèn)該氣體的成分為 ����。?
【答案】:猜想3:氣體為CO2和SO2的混合氣體
(1)B
(2)驗(yàn)證混合氣體中是否含有SO2
(3)驗(yàn)證混合氣體中是否含有CO2
(4)CO2和SO2的混合氣體
變式訓(xùn)練2-1
14��、
檢驗(yàn)SO2氣體中是否混有CO2氣體,可采用的方法是( )
A.通過(guò)品紅溶液
B.通過(guò)澄清石灰水
C.先通過(guò)NaOH溶液,再通過(guò)澄清石灰水
D.先通過(guò)酸性KMnO4溶液,再通過(guò)澄清石灰水
【答案】:D
【解析】:SO2�����、CO2都能使澄清石灰水變渾濁,需先除去SO2,再檢驗(yàn)CO2�。SO2具有還原性,而CO2沒(méi)有,可根據(jù)此特點(diǎn)除去SO2。
變式訓(xùn)練2-2
下列有關(guān)二氧化硫和二氧化碳的說(shuō)法中正確的是( )
A.二者都有還原性
B.都能使紫色石蕊溶液先變紅后褪色
C.二者都有一定的氧化性
D.都能與石灰水反應(yīng),但現(xiàn)象不同
【答案】:C
【解析】:CO2無(wú)還原性,A錯(cuò)誤;SO2和CO2都只能使紫色石蕊溶液變紅,B錯(cuò)誤;CO2和SO2與石灰水反應(yīng)現(xiàn)象相同,D錯(cuò)誤����。
變式訓(xùn)練2-3
下列溶液中能夠區(qū)別SO2和CO2氣體的是( )
①石灰水 ②H2S溶液?��、鬯嵝訩MnO4溶液?�、苈人����、萜芳t溶液
A.①②③ B.②③④
C.②③④⑤ D.①②③④⑤
【答案】:C
 2022年秋高中化學(xué) 初高中銜接 專(zhuān)題21 硫及其氧化物學(xué)案
2022年秋高中化學(xué) 初高中銜接 專(zhuān)題21 硫及其氧化物學(xué)案