《湖南省茶陵縣高中化學(xué) 第三章 烴的含氧衍生物 3.2 烴的衍生物 醛課件 新人教版選修5.ppt》由會員分享��,可在線閱讀,更多相關(guān)《湖南省茶陵縣高中化學(xué) 第三章 烴的含氧衍生物 3.2 烴的衍生物 醛課件 新人教版選修5.ppt(34頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索����。
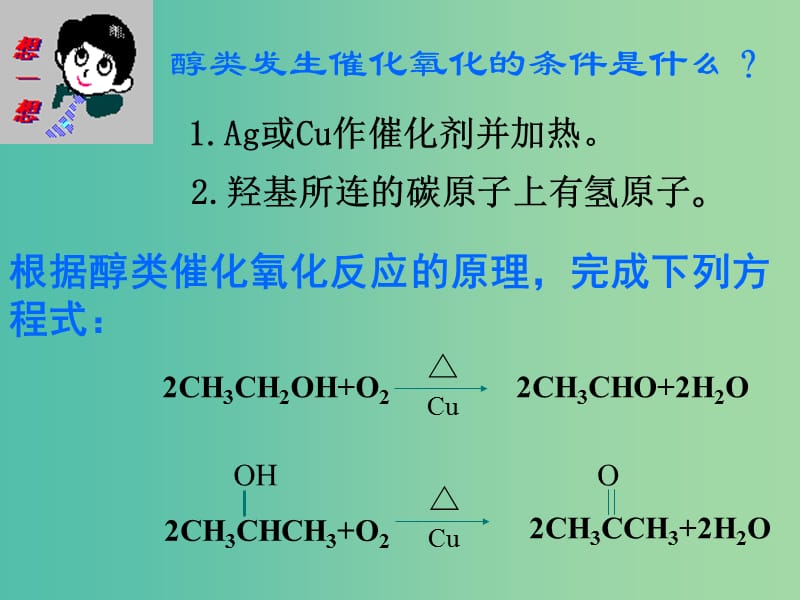
1、根據(jù)醇類催化氧化反應(yīng)的原理��,完成下列方程式:,醇類發(fā)生催化氧化的條件是什么�?,1.Ag或Cu作催化劑并加熱。,2.羥基所連的碳原子上有氫原子���。,2CH3CHO+2H2O,第三章 烴的含氧衍生物,第二節(jié) 醛,兒童房甲醛超標(biāo)易誘發(fā)兒童白血病,去甲醛十大植物高手,吊蘭,龍舌蘭,乙醛分子比例模型,乙醛分子球棍模型,1����、醛的定義:,結(jié)構(gòu)式,結(jié)構(gòu)簡式,不能寫成,電子式,由烴基跟醛基相連而構(gòu)成的化合物����。,飽和一元醛的通式: CnH2n+1CHO 或CnH2nO (n≥1),—CHO,—COH,一、醛的結(jié)構(gòu)和物理性質(zhì),醛,脂肪醛,芳香醛,一元醛,二元醛,多元醛,,,
2��、飽和醛��、不飽和醛,,R,2�����、醛的分類:,3、常見的醛:,甲醛:,HCHO是最簡單的醛��,為無色���、有刺激性氣味的氣體�����,35%~40%的甲醛水溶液又稱福爾馬林�,具有殺菌�����、防腐性能��。,乙醛:,乙醛是一種沒有顏色�,有刺激性氣味的液體,密度比水小�,沸點(diǎn)20.8℃,易揮發(fā)易燃燒�,易溶于水及乙醇、乙醚�、氯仿等有機(jī)溶劑。,苯甲醛,肉桂醛,二�、乙醛的分子結(jié)構(gòu),分子式,結(jié)構(gòu)簡式 CH3CHO,結(jié)構(gòu)式,官能團(tuán),C2H4O,P56 圖3-12 核磁共振氫譜,乙醛分子結(jié)構(gòu)中含有兩類不同位置的氫原子,因此在核磁共振氫譜中有兩組峰����,峰的面積與氫原子數(shù)成正比。因此峰面積較大或峰高較高的是甲基氫原子��,反之�����,是醛基上的氫原子�����。,
3�、,,思考:分析醛基的結(jié)構(gòu),推測其在化學(xué)反應(yīng)中的斷裂方式判斷醛基有哪些性質(zhì)�����?,醛基中碳氧雙鍵發(fā)生加成反應(yīng)���,被H2還原為醇,,氧化性,還原性,醛基中碳?xì)滏I較活潑�,能被氧化成相應(yīng)羧酸,1��、加成反應(yīng),根據(jù)加成反應(yīng)的概念寫出CH3CHO 和H2 加成反應(yīng)的方程式。,,三�、乙醛的化學(xué)性質(zhì),這個(gè)反應(yīng)屬于氧化反應(yīng)還是還原反應(yīng)?為什么��?,因?yàn)樵谟袡C(jī)化學(xué)反應(yīng)里���,通??梢詮募託浠蛉鋪矸治鲅趸€原反應(yīng),a. 催化氧化,乙醛可以被還原為乙醇�, 能否被氧化?,,,氧化,乙醛,,還原,,乙酸,,氧化,乙醇,:取一潔凈試管��,加入1ml 2%的AgNO3溶液�,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解���。,:在配好的上述銀氨
4���、溶液中滴入三滴乙醛溶液,然后把試管放在熱水浴中靜置�。,a、配制銀氨溶液,b����、水浴加熱生成銀鏡,(1)銀鏡反應(yīng),,2���、氧化反應(yīng)(既能被弱氧化劑氧化,又能被空氣中的O2氧化),由于生成的銀附著在試管壁上形成銀鏡�,所以叫銀鏡反應(yīng),注意點(diǎn):,1)試管內(nèi)壁要潔凈�����,否則得不到光亮的銀鏡��; 2)必須水浴加熱���,不可振蕩和搖動(dòng)試管��; 3)須用新配制的銀氨溶液���,現(xiàn)用現(xiàn)配; 4)乙醛用量不可太多實(shí)驗(yàn)后�,銀鏡用HNO3浸泡,再用水洗�;,7)1mol –CHO被氧化,就應(yīng)有2mol Ag生成�����;,5)配制銀氨溶液時(shí)向稀AgNO3中滴加稀氨水,直至最初生成的沉淀恰好溶解為止����;順序不能反 6)該反應(yīng)需在堿性環(huán)境中進(jìn)行,酸性環(huán)
5���、境會破壞Ag(NH3)2��;,銀鏡反應(yīng)有什么應(yīng)用���, 有什么工業(yè)價(jià)值?,應(yīng)用: 檢驗(yàn)醛基的存在,,工業(yè)上用來制瓶膽和鏡子,a�、配制新制的Cu(OH)2懸濁液:在試管里加入2mL 10%NaOH溶液,滴入2%CuSO4溶液4~6滴��,振蕩�。,b、乙醛的氧化:在上述藍(lán)色濁液中加入0.5ml乙醛溶液����,加熱至沸騰。,(2)與新制的氫氧化銅反應(yīng),現(xiàn)象:①中有藍(lán)色絮狀沉淀��, ③中有紅色(Cu2O)沉淀生成,,醫(yī)學(xué)上檢驗(yàn)病人是否患糖尿病,注意點(diǎn):,(1)氫氧化銅溶液一定要新制, 堿一定要過量�; (2)加熱至沸騰,才能有明顯的紅色 沉淀����; (3)加熱煮沸時(shí)間不宜過長;,寫出甲醛發(fā)生銀鏡反應(yīng)�����,以及與新制的 氫
6�、氧化銅反應(yīng)的化學(xué)方程式,,思考:1mol甲醛最多可以還原得到多少molAg?,,1mol甲醛最多可以還原得到多少mol Ag�?,即:H2CO3,,,注:由于甲醛分子相當(dāng)于含有2個(gè)醛基,所以1mol甲醛發(fā) 生銀鏡反應(yīng)時(shí)最多可生成4mol Ag 1mol甲醛與新制的氫氧化銅反應(yīng)最多可生成2molCu2O,【思考】乙醛能否使溴水或酸性KMnO4溶液褪色��?,能,(3)�����、與氧氣反應(yīng),a.燃燒,b.在一定溫度和催化劑條件下:,CnH2n+2O CnH2n O CnH2nO2,結(jié)合乙醛的結(jié)構(gòu)�����,說明乙醛的氧化反應(yīng)和還原反應(yīng)有什么特點(diǎn)�?,乙醛能發(fā)生氧化反應(yīng)是由于醛基上的H原子受C=O的影響,活性增強(qiáng),能
7��、被氧化劑所氧化��;能發(fā)生還原反應(yīng)是由于醛基上的C=O與C=C類似����,可以與H2發(fā)生加成反應(yīng)。,學(xué)與問,化學(xué)性質(zhì) (1)和H2加成被還原成醇 (2)氧化反應(yīng) a. 燃燒 b. 催化氧化成羧酸 c. 被弱氧化劑氧化 Ⅰ��、銀鏡反應(yīng) Ⅱ�、與新制的氫氧化銅反應(yīng) d. 使酸性KMnO4溶液和溴水褪色,本節(jié)小結(jié):醛類的化學(xué)性質(zhì),還原反應(yīng):加氫或失氧,氧化反應(yīng):加氧或失氫,,有機(jī)的氧化還原反應(yīng),鞏固練習(xí),1、用化學(xué)方法鑒別下列各組物質(zhì) (1)溴乙烷 ����、乙醇 、乙醛 (2)苯����、甲苯、乙醇�����、1-己烯���、甲醛�、苯酚,(1)用新制氫氧化銅溶液重鉻酸甲酸性溶液,(2)用溴水、用新制氫氧
8�����、化銅溶液�、酸性高錳酸鉀溶液,2、一定量的某飽和一元醛發(fā)生銀鏡反應(yīng)�����,析出銀21.6g�,等量的此醛完全燃燒時(shí)生成CO2 8.9L��,則此醛是( ),A�、乙醛 B、丙醛 C�����、丁醛 D���、2-甲基丙醛,CD,一����、乙醛的制法,【知識拓展】,二、醛的命名及同分異構(gòu),1���、醛類的命名: ①選主鏈時(shí)要選含有醛基的最長碳鏈���; ②編號時(shí)要從醛基上的碳原子開始; ③名稱中不必對醛基定位����,因醛基必然在其主鏈的邊端。,2�、醛類的同分異構(gòu),包括碳鏈異構(gòu)�,醛基的位置異構(gòu),以及官能團(tuán)異構(gòu)(醛與碳的酮�����、烯醇為同分異構(gòu))�。,【知識拓展】,>C=O稱羰基,是酮的官能團(tuán)�����,丙酮是最簡單的酮。在常溫下����,丙酮是無色透明的液體,易揮發(fā)���,具有令人愉快的氣味����,能與水�����、乙醇等混溶����,是一種重要的有機(jī)溶劑和化工原料����。,科學(xué)視野,酮:羰基碳原子與兩個(gè)烴基相連的化合物。,丙酮,丙酮不能被銀氨溶液���、新制的氫氧化銅等弱氧化劑氧化����,但可催化加氫生成醇。,酮,,羰基的兩端連有兩個(gè)烴基的化合物,飽和的一元酮為CnH2nO(n≥3),,主要化學(xué)性質(zhì) 1���、加成反應(yīng):,2����、難被氧化(燃燒除外): 難被銀氨溶液或新制氫氧化銅氧化,
 湖南省茶陵縣高中化學(xué) 第三章 烴的含氧衍生物 3.2 烴的衍生物 醛課件 新人教版選修5.ppt
湖南省茶陵縣高中化學(xué) 第三章 烴的含氧衍生物 3.2 烴的衍生物 醛課件 新人教版選修5.ppt