《高考化學(xué) 周周練 弱電解質(zhì)的電離 電離平衡練習(xí)》由會(huì)員分享�,可在線閱讀,更多相關(guān)《高考化學(xué) 周周練 弱電解質(zhì)的電離 電離平衡練習(xí)(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
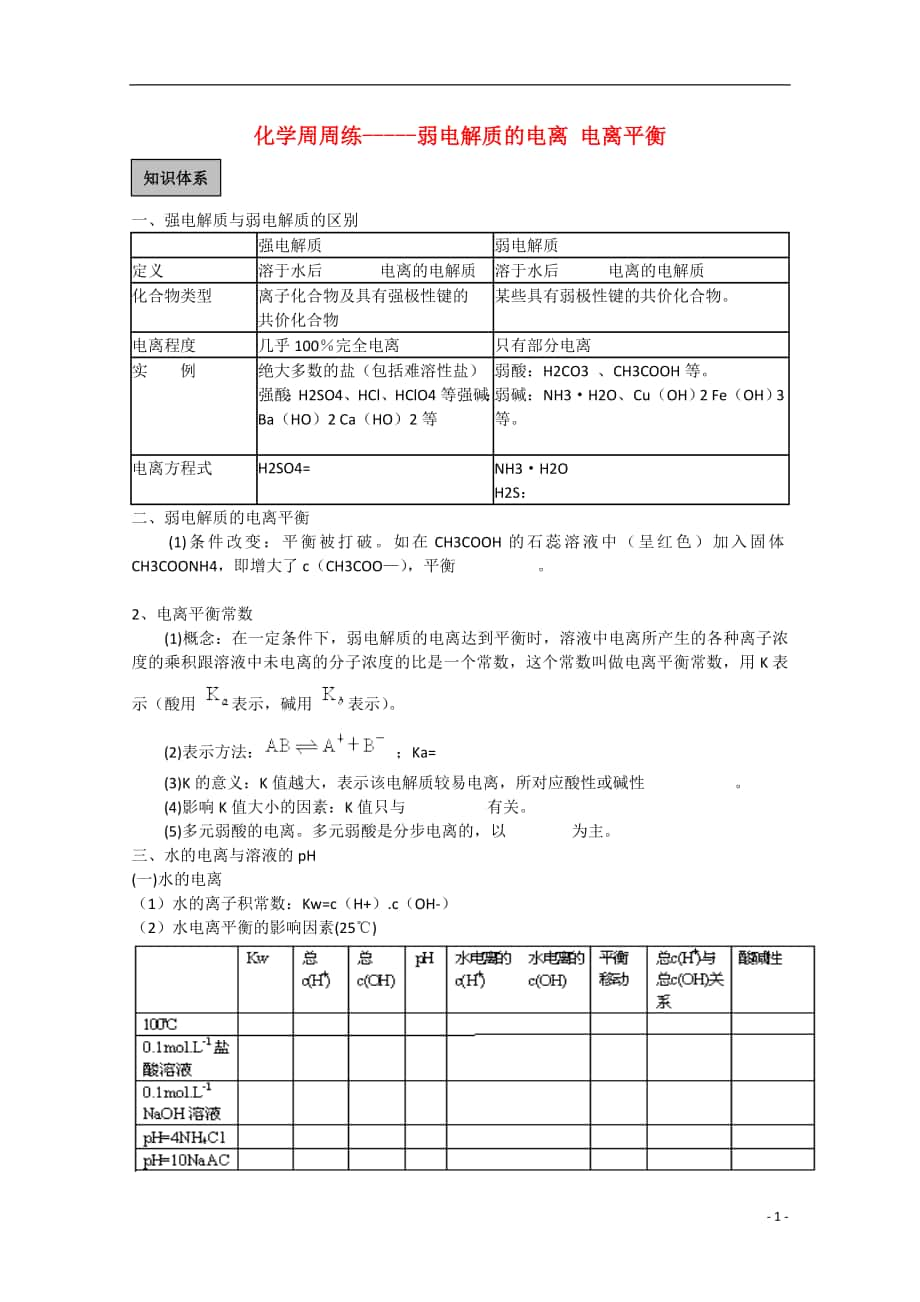
1、 化學(xué)周周練-弱電解質(zhì)的電離 電離平衡知識(shí)體系一���、強(qiáng)電解質(zhì)與弱電解質(zhì)的區(qū)別 強(qiáng)電解質(zhì)弱電解質(zhì)定義溶于水后 電離的電解質(zhì)溶于水后 電離的電解質(zhì)化合物類型離子化合物及具有強(qiáng)極性鍵的共價(jià)化合物某些具有弱極性鍵的共價(jià)化合物����。電離程度幾乎100完全電離只有部分電離實(shí) 例絕大多數(shù)的鹽(包括難溶性鹽)強(qiáng)酸:H2SO4����、HCl、HClO4等強(qiáng)堿:Ba(HO)2 Ca(HO)2等弱酸:H2CO3 ���、CH3COOH等��。弱堿:NH3H2O��、Cu(OH)2 Fe(OH)3等����。電離方程式H2SO4= NH3H2O H2S: 二、弱電解質(zhì)的電離平衡(1)條件改變:平衡被打破�。如在CH3COOH的石蕊溶液中(呈紅色)加入固
2、體CH3COONH4�����,即增大了c(CH3COO)�����,平衡 �����。2�、電離平衡常數(shù)(1)概念:在一定條件下,弱電解質(zhì)的電離達(dá)到平衡時(shí)����,溶液中電離所產(chǎn)生的各種離子濃度的乘積跟溶液中未電離的分子濃度的比是一個(gè)常數(shù),這個(gè)常數(shù)叫做電離平衡常數(shù)�,用K表示(酸用 表示,堿用 表示)�����。(2)表示方法: ���;Ka= (3)K的意義:K值越大����,表示該電解質(zhì)較易電離��,所對(duì)應(yīng)酸性或堿性 ���。(4)影響K值大小的因素:K值只與 有關(guān)����。(5)多元弱酸的電離�����。多元弱酸是分步電離的���,以 為主�����。三�、水的電離與溶液的pH(一)水的電離(1)水的離子積常數(shù):Kw=c(H+).c(OH-)(2)水電離平衡的影響因素(25)(二)溶液的pH1、
3���、酸性溶液:按CCH+pH 2�、堿性溶液:按CCOH-CH+pH 3���、強(qiáng)酸��、強(qiáng)堿溶液的稀釋后:對(duì)于酸溶液中的CH+��,每稀釋10n倍����,pH增大n個(gè)單位�,但增大后不超過(guò)7,酸仍為酸����!如PH=3的鹽酸稀釋100倍�,PH= �;稀釋1000倍�,PH 對(duì)于堿溶液中的COH-,每稀釋10 n倍��,pH減少n個(gè)單位�,但減少后不小于7,堿仍為堿�����! 如PH=11的鹽酸稀釋100倍�,PH= ;稀釋1000倍��,PH pH值相同的強(qiáng)酸與弱酸(或強(qiáng)堿與弱堿)���,稀釋相同的倍數(shù)�,pH變化為 . 4�����、強(qiáng)酸與強(qiáng)弱溶液混合的計(jì)算: 反應(yīng)的實(shí)質(zhì):H+OH-=H2O 三種情況:(1)恰好中和�,pH=7 (2)若余酸����,先求中和后的CH+����,再
4、求pH���。 (3)若余堿����,先求中和后的COH-���,再通過(guò)KW求出CH+����,最后求pH���。 5�、已知酸和堿溶液的pH之和����,判斷等體積混合后的溶液的p H (1)若強(qiáng)酸與強(qiáng)堿溶液的pH之和等于14�����,則混合后顯 (2)若強(qiáng)酸與強(qiáng)堿溶液的pH之和大于14���,則混合后顯 ���。 基礎(chǔ)過(guò)關(guān)1����、下列物質(zhì)的水溶液都能導(dǎo)電�����,但屬于弱電解質(zhì)的是( ) A���、CH3COOH B����、Cl2 C�����、NH4HCO3 D、SO22����、已知HClO是比H2CO3還弱的酸,氯水中存在下列平衡:Cl2+H2OHCl+HClO��,HClO H+ClO ���,達(dá)平衡后�,要使HClO濃度增加����,可加入( )A、H2S B��、CaCO3 C����、HCl D、NaOH 3���、
5�、25時(shí),在0.01mol/L的稀硫酸中�,水電離出的H+是( )A. 510-13mol/L B. 002mol/L C. 110-7mol/L D. 110-12mol/L4、pH=13的強(qiáng)堿溶液與pH=2的強(qiáng)酸溶液混合����,混合液后pH=11,則強(qiáng)堿與強(qiáng)酸的體積比是( ) A. 11:1 B. 9:1 C. 1:9 D. 1:115�、7. pH相同的醋酸溶液和鹽酸,分別用蒸餾水稀釋至原體積的m倍和n倍����,稀釋后兩溶液的pH仍相同����,則m和n的關(guān)系是 A. m = n B. m n C. mn D. 無(wú)法判斷6、用中和滴定法測(cè)定燒堿的純度���,若燒堿中含有與酸不反應(yīng)的雜質(zhì)�����,試根據(jù)實(shí)驗(yàn)回答:將準(zhǔn)確稱取的4.
6���、3g燒堿樣品配成250mL待測(cè)液,需要的主要儀器除量筒、燒杯���、玻璃棒外����,還必須用到的儀器有 ���、 �。取10.00mL待測(cè)液�,用 式滴定管量取。用0.2010molL-1標(biāo)準(zhǔn)鹽酸滴定待測(cè)燒堿溶液�����,滴定時(shí)左手旋轉(zhuǎn)酸式滴定管的玻璃活塞����,右手不停地?fù)u動(dòng)錐形瓶,兩眼注視 ����,直到滴定到終點(diǎn)。根據(jù)下列數(shù)據(jù)��,燒堿的純度為 。滴定次數(shù)待測(cè)液體積(mL)標(biāo)準(zhǔn)鹽酸體積(mL)滴定前讀數(shù)(mL)滴定后讀數(shù)(mL)第一次10.000.5020.40第二次10.004.0024.10以標(biāo)準(zhǔn)的鹽酸溶液滴定未知的氫氧化鈉溶液為例,判斷下列操作引起的誤差(填“偏大”����、“偏小” “無(wú)影響”或“無(wú)法判斷”)讀數(shù):滴定前平視,滴定后俯視 未用標(biāo)準(zhǔn)液潤(rùn)洗滴定管 用待測(cè)液潤(rùn)洗錐形瓶 不小心將標(biāo)準(zhǔn)液滴在錐形瓶外面 滴定接近終點(diǎn)時(shí)����,用少量蒸餾水沖洗錐形瓶?jī)?nèi)壁 - 3 -
 高考化學(xué) 周周練 弱電解質(zhì)的電離 電離平衡練習(xí)
高考化學(xué) 周周練 弱電解質(zhì)的電離 電離平衡練習(xí)